全氟辛酸是环境中普遍存在的高毒性持久性有机污染物,可通过食物,饮用水等途径进入人体。全氟辛酸暴露会引起一系列的健康危害,包括肝损伤、肾脏疾病、潜在致癌风险等。采用啮齿类动物为模式生物的肝毒性研究发现全氟辛酸可诱导过氧化物酶受体激活受体(PPAR),从而导致啮齿类动物的肝癌。但近期的体外实验和流行病学发现全氟辛酸暴露后,人体会出现肝损伤,但PPAR有时并不被激活,进而也不会诱发肝癌的产生。因此亟需揭示不同暴露剂量下全氟辛酸肝毒性的分子机制,为全氟类化合物的风险评价和安全管理提供理论依据。
图1. 全氟辛酸诱发哺乳动物肝细胞凋亡的分子通路:PPAR激活(雄性小鼠)和ETC-Complex I抑制(雌性小鼠)
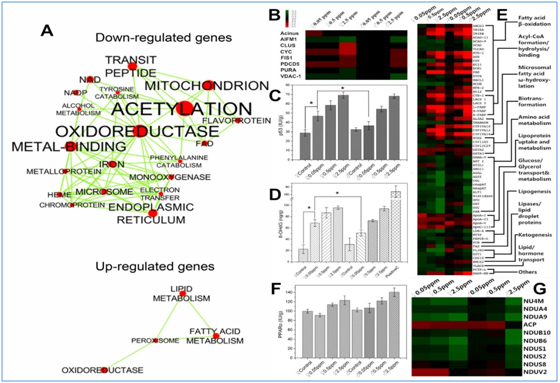
我院马奇英教授,崔昕毅副教授与我院韦斯副教授合作,采用体内(雌雄小鼠)和体外(人体肝细胞HL-7702)测试,结合蛋白组学技术研究了不同暴露剂量下全氟辛酸对哺乳动物肝脏的分子致毒机制。组织病理切片、半胱天冬酶(Caspase-9)活性测定等发现高、中剂量全氟辛酸暴露后,雌雄小鼠体内均出现肝凋亡现象。低剂量暴露时,雌性小鼠较雄性小鼠更为敏感。进一步应用iTRAQ技术对小鼠肝脏进行了蛋白组学的测定,并使用Western Blot和ELISA等技术对蛋白组学结果进行验证。结果表明:高、中剂量的全氟辛酸亚慢性暴露可诱发小鼠肝凋亡,主要的分子途径为:全氟辛酸诱发活性氧的超积累,进而引发小鼠肝细胞的氧化损伤,诱导产生DNA损伤,从而激活p53通路。而低剂量暴露下,雌雄小鼠肝细胞中活性氧来源于不同的信号通路。雄性小鼠体内的活性氧主要来源于PPAR通路激活;雌性小鼠体内的活性氧主要是氧化呼吸链中Complex I超分子复合体的亚基受到抑制而产生。由于该通路中产生活性氧的能力远超PPAR通路,因此雌性小鼠对低剂量全氟辛酸暴露诱导的肝凋亡更为敏感。体外肝细胞(HL-7702)体外测试进一步验证了该分子机制。该研究揭示的不同剂量/性别的全氟辛酸肝毒性的分子诱导机制可以很好的解释人群流行病学的研究结果,为全氟化合物的健康风险评价提供有力的理论支撑。此外结合该毒性结果和现有的安全阈值标准,也对全氟辛酸的安全管理提出了建议。
这一研究成果近日在线发表于环境学科国际权威期刊Environmental Science & Technology (DOI: 10.1021/acs.est.7b02690),论文第一作者为李侃助理研究员,通讯作者为崔昕毅副教授和韦斯副教授,马奇英教授为共同作者。该研究得到国家自然科学基金面上项目、江苏省创新团队计划的资助。